Wasser verhält sich anders als die meisten anderen chemischen Stoffe. In fast allen Substanzen fügen sich Atome und Moleküle umso dichter zusammen, je kälter es wird. Sie erstarren. Wasser hingegen hat seine größte Dichte bei 4 Grad Celsius, weil sich die Wassermoleküle bei dieser Temperatur am dichtesten zusammenlagern. Viele Süßwasserseen weisen an ihrer tiefsten Stelle eine Temperatur von 4 Grad auf, weil das schwere Wasser zu Boden sinkt. In der festen Phase, im Eiskristall, liegen die Wassermoleküle erstaunlicherweise wieder weiter auseinander. Man spricht daher auch von der Anomalie des Wassers. Eis ist also leichter und schwimmt oben. So sind auch die großen Meeresgebiete in polaren Breiten mit Eis bedeckt. Die Ursache für diese Anomalie sind die besonderen Eigenschaften des Wassermoleküls (H
2O). Sein Sauerstoffatom (O) und die beiden Wasserstoffatome (H) sind asymmetrisch angeordnet. Das Wassermolekül wird damit zum Dipol, zu einem Molekül mit einem negativ und einem positiv geladenen Ende.
Je nach Temperatur ordnen sich diese Dipole nach ihren Ladungen zu Aggregaten zusammen – beispielsweise zu einem Eiskristall. Der Dipolcharakter des Wassers ist für das Klima ganz entscheidend: Da die Wasserdipole wie kleine Magnete zusammenhalten, reagiert Wasser relativ träge auf Erwärmung oder Abkühlung. Tatsächlich besitzt Wasser die höchste Wärmekapazität unter den flüssigen und festen Stoffen – mit Ausnahme von Ammoniak. Das bedeutet, dass Wasser große Mengen Wärme aufnehmen kann, bevor es verdampft. Auch der Gefrier- und der Siedepunkt des Wassers (0 beziehungsweise 100 Grad Celsius), die so alltäglich erscheinen, sind eher ungewöhnlich. Wäre das Wassermolekül symmetrisch und damit kein Dipol, würde Wasser schon bei minus 110 Grad Celsius schmelzen und bei minus 80 Grad sieden. Die Trägheit des Klimas ist vor allem Folge dieser hohen Wärmekapazität.
Das Wasser beeinflusst das Klima aber nicht nur im flüssigen oder festen Zustand. In Form von Wasserdampf hat H
2O einen entscheidenden Einfluss auf den Wärmehaushalt der Erde: Wasserdampf allein trägt zu etwa zwei Dritteln zum natürlichen Treibhauseffekt bei. Zudem verstärkt es die Klimawirkung anderer Stoffe. Steigt beispielsweise die Temperatur infolge eines höheren Kohlendioxidgehalts, so steigt auch der Gehalt an Wasserdampf, da eine wärmere Atmosphäre dauerhaft mehr Wasserdampf speichern kann. Da Wasser wegen seines Dipols Infrarotstrahlung sehr wirksam absorbiert, verdoppelt es in etwa die ursprüngliche durch das Kohlendioxid hervorgerufene Erwärmung. Eine weitere Eigenschaft des Wassers ist, dass es Salze lösen kann. Der Salzgehalt des Meeres beträgt durchschnittlich 34,7 Promille. Dieser verändert wiederum die Eigenschaften des Wassers. So verschiebt sich das Dichtemaximum von plus 4 Grad beim Süßwasser auf minus 3,8 Grad. Dieser Wert liegt sogar unter dem Gefrierpunkt von Meerwasser von minus 1,9 Grad. Anders als im Süßwasser nimmt die Dichte des Salzwassers also zu, wenn es unter plus 4 Grad Celsius abkühlt. So bildet sich dichtes Wasser, bis schließlich die Eisbildung einsetzt. Diese Dichteeigenart ist der Motor für eines der wichtigsten Elemente des Klimasystems – die Konvektion: Abgekühltes dichtes und damit schweres Salzwasser sinkt in die Tiefe ab. An der Meeresoberfläche strömt relativ warmes Wasser nach.
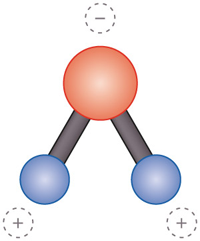
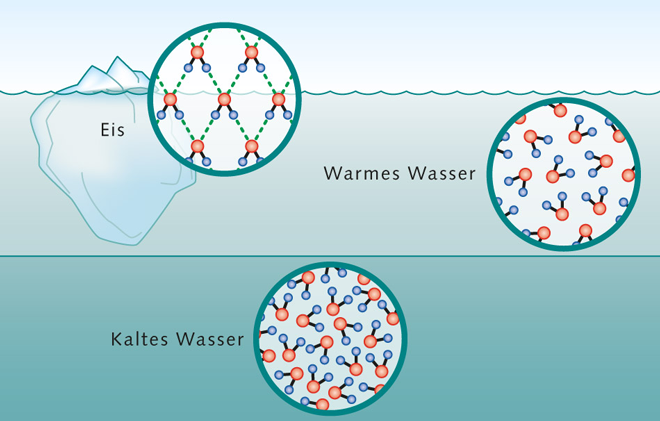
1.7 > Das Wassermolekül ist asymmetrisch und weist daher auf seinen beiden Seiten unterschiedliche Ladungen auf (links). Man spricht von einem Dipol. Dadurch verhält es sich anders als andere Substanzen. Eis ist weniger dicht (oben) und schwimmt an der Oberfläche. 4 Grad kaltes Süßwasser ist am dichtesten (unten) und sinkt in die Tiefe. Warmes Wasser schichtet sich darüber ein (Mitte).
Abb. 1.7: © maribus

